PECFENT 100 microgrammes-pulvérisation, solution pour pulvérisation nasale, boîte de 1 flacon pulvérisateur de 8 pulvérisations
Dernière révision : 16/05/2024
Taux de TVA : 2.1%
Prix de vente : 43,11 €
Taux remboursement SS : 65%
Base remboursement SS : 43,11 €
Laboratoire exploitant : KYOWA KIRIN INTERNATIONAL NEWCO FRANCE SAS
PecFent est indiqué dans le traitement des accès douloureux paroxystiques (ADP) chez l'adulte recevant déjà un traitement de fond opioïde pour des douleurs chroniques d'origine cancéreuse. Un accès douloureux paroxystique est une exacerbation passagère d'une douleur chronique par ailleurs contrôlée par un traitement de fond.
Les patients sous traitement opioïde de fond sont ceux prenant au moins 60 mg par jour de morphine par voie orale, au moins 25 microgrammes par heure de fentanyl transdermique, au moins 30 mg par jour d'oxycodone, au moins 8 mg par jour d'hydromorphone par voie orale ou une dose équianalgésique d'un autre opioïde depuis au moins une semaine.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Patients non traités par un traitement de fond morphinique, en raison d'un risque accru de dépression respiratoire.
Dépression respiratoire sévère ou bronchopneumopathie obstructive sévère.
Traitement de la douleur aiguë autre que les accès douloureux paroxystiques.
Patients traités avec des médicaments contenant de l'oxybate de sodium.
En raison des risques, associés à l'exposition accidentelle, au mésusage et à l'abus, pouvant avoir une issue fatale les patients et leurs aidants doivent être informés qu'ils doivent conserver PecFent dans un endroit sûr et sécurisé, inaccessible à d'autres personnes.
Il est impératif d'informer les patients et leurs aidants que PecFent contient une substance active en quantité susceptible d'être fatale pour un enfant.
Afin de réduire au minimum les risques d'effets indésirables associés aux opioïdes et de déterminer la dose efficace, il est impératif que les patients soient surveillés étroitement par des professionnels de santé durant la phase de titration.
Il est important que le traitement de fond de la douleur chronique du patient par un opioïde à action prolongée soit stabilisé avant d'instaurer le traitement par PecFent.
Hyperalgésie
Comme avec les autres opioïdes, en cas de contrôle insuffisant de la
douleur en réponse à une dose plus élevée de fentanyl, la possibilité
d'hyperalgésie induite par les opioïdes doit être envisagée. Une
réduction de la dose de fentanyl, l'arrêt du traitement par le fentanyl
ou une réévaluation du traitement peuvent être indiqués.
Dépression respiratoire
Il existe un risque de dépression respiratoire cliniquement
significative associé à l'utilisation du fentanyl. Les patients
douloureux sous traitement opioïde chronique développent une tolérance
à la dépression respiratoire, ce qui réduit le risque de survenue de
cet effet chez ces patients. L'utilisation concomitante de dépresseurs
du système nerveux central peut accroître le risque de dépression
respiratoire (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Pathologie pulmonaire chronique
Chez les patients atteints de bronchopneumopathie chronique
obstructive, le fentanyl peut entraîner des effets indésirables plus
graves. Chez ces patients, les opioïdes peuvent diminuer la commande
respiratoire et accroître la résistance des voies aériennes.
Augmentation de la pression intracrânienne
PecFent ne doit être administré qu'avec une extrême prudence chez les
patients qui pourraient être particulièrement sensibles aux effets
intracrâniens de l'hypercapnie, notamment ceux présentant des signes
d'hypertension intracrânienne ou des troubles de la conscience. Les
opioïdes peuvent masquer l'évolution clinique des patients présentant
un traumatisme crânien et ne doivent être utilisés qu'en cas de
nécessité clinique.
Pathologie cardiaque
Le fentanyl peut provoquer une bradycardie. PecFent doit donc être
utilisé avec prudence chez les patients présentant des antécédents de
bradyarythmie ou une bradyarythmie préexistante.
Insuffisance rénale ou hépatique
PecFent doit également être administré avec prudence aux patients
insuffisants hépatiques ou rénaux. L'influence de l'insuffisance
hépatique ou rénale sur la pharmacocinétique du médicament n'a pas été
étudiée ; cependant, lorsque le fentanyl est administré par voie
intraveineuse, sa clairance est modifiée en cas d'insuffisance
hépatique ou rénale en raison d'une altération de la clairance
métabolique et de la liaison aux protéines plasmatiques. Par
conséquent, des précautions particulières s'imposent pendant la phase
de titration chez les patients présentant une insuffisance rénale ou
hépatique modérée ou sévère.
Une attention particulière doit être portée aux patients présentant une hypovolémie et une hypotension.
Tolérance et troubles liés à l'utilisation d'opioïdes (abus et dépendance)
Une accoutumance (tolérance) et une dépendance physique et/ou
psychologique peuvent apparaître lors de l'administration répétée
d'opioïdes comme le fentanyl.
L'utilisation répétée de PecFent peut conduire à un trouble lié à l'utilisation d'opioïdes (TUO). Une dose plus élevée et une durée plus longue du traitement par opioïdes peuvent augmenter le risque de développer un TUO. L'abus ou le mésusage intentionnel de PecFent peut entraîner un surdosage et/ou le décès. Le risque de développement d'un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou fratrie) de troubles liés à l'utilisation de substances addictogènes (y compris de troubles liés à la consommation d'alcool), en cas de tabagisme actif ou chez les patients ayant des antécédents personnels d'autres troubles de la santé mentale (par exemple dépression majeure, troubles anxieux et troubles de la personnalité).
Avant l'instauration du traitement par PecFent et pendant le traitement, les objectifs du traitement et un plan d'arrêt doivent être convenus en accord avec le patient (voir rubrique Posologie et mode d'administration). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d'apparition de ces signes, les patients doivent être invités à contacter leur médecin.
Les patients devront être surveillés afin de détecter tout signe de recherche compulsive du produit (par exemple demande de renouvellement trop précoce de la prescription). Dans ce cadre, les médicaments psychoactifs (tels que les benzodiazépines) et opioïdes utilisés en concomitance devront être passés en revue. Pour les patients présentant des signes et symptômes de TUO, une consultation auprès d'un addictologue devra être envisagée.
Les athlètes doivent être informés que le traitement par le fentanyl peut induire des résultats positifs lors des contrôles antidopage.
Syndrome sérotoninergique
Il est conseillé de faire preuve de prudence lorsque PecFent est
administré en association avec des médicaments qui affectent les
systèmes de neurotransmission sérotoninergique.
Un syndrome sérotoninergique, susceptible de mettre en jeu le pronostic vital, peut se développer lors de l'utilisation concomitante de médicaments sérotoninergiques tels que des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), ainsi qu'avec des médicaments qui altèrent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [IMAO]). Cela peut se produire aux doses recommandées (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Le syndrome sérotoninergique peut s'accompagner d'altérations de l'état mental (p. ex. agitation, hallucinations, coma), d'une instabilité du système nerveux autonome (p. ex. tachycardie, pression artérielle labile, hyperthermie), de troubles neuromusculaires (p. ex. hyperréflexie, incoordination, rigidité) et/ou de symptômes gastro-intestinaux (p. ex. nausées, vomissements, diarrhée).
En cas de suspicion de syndrome sérotoninergique, il convient d'arrêter le traitement par PecFent.
Voie d'administration
PecFent est destiné à être administré uniquement par voie nasale, à
l'exclusion de toute autre voie. En raison des propriétés
physico-chimiques des excipients inclus dans la formulation,
l'injection intraveineuse ou intra-artérielle doit notamment être
évitée.
État de la muqueuse nasale
Si le patient présente des épisodes récurrents d'épistaxis ou de gêne
au niveau du nez lors de l'administration de PecFent, il convient
d'envisager un autre mode d'administration pour le traitement des accès
douloureux paroxystiques.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au
sommeil incluant une apnée centrale du sommeil (ACS) et une hypoxémie
liée au sommeil. L'utilisation d'opioïdes augmente de façon
dose-dépendante le risque d'ACS. Chez les patients présentant une ACS,
une diminution de la dose totale d'opioïdes doit être envisagée.
Utilisation concomitante avec des sédatifs
L'utilisation concomitante de PecFent et de médicaments sédatifs tels
que les benzodiazépines ou les médicaments apparentés peut entraîner
une sédation, une dépression respiratoire, un coma et le décès. En
raison de ces risques, la prescription concomitante avec ces
médicaments sédatifs doit être réservée aux patients pour lesquels il
n'existe pas d'alternatives thérapeutiques. S'il est décidé de
prescrire PecFent avec des médicaments sédatifs, la dose minimale
efficace doit être utilisée et la durée de traitement doit être la plus
courte possible.
Les patients doivent être étroitement surveillés afin que des signes et symptômes de dépression respiratoire et de sédation puissent être détectés.
À cet égard, il est fortement recommandé d'informer les patients et leurs aidants afin qu'ils prennent conscience de ces symptômes (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Excipients de PecFent
PecFent contient du parahydroxybenzoate de propyle (E216). Peut
provoquer des réactions allergiques (éventuellement retardées) et,
exceptionnellement, des bronchospasmes (si le médicament n'est pas
administré correctement).
Résumé du
profil de sécurité
Les effets
indésirables attendus avec PecFent sont les effets
typiques des opioïdes. Le plus souvent, ils cesseront ou diminueront
d'intensité avec la poursuite du traitement, une fois la titration réalisée
avec succès. Cependant, les effets indésirables les plus graves sont la
dépression respiratoire (pouvant conduire à une apnée ou un arrêt
respiratoire), la dépression circulatoire, l'hypotension et l'état de choc ;
l'apparition éventuelle de ces effets doit être surveillée chez tous les
patients.
Les études cliniques menées avec PecFent ayant été conçues pour évaluer l'efficacité et la sécurité du produit dans le traitement des accès douloureux paroxystiques, tous les patients recevaient également d'autres opioïdes (morphine à libération prolongée ou fentanyl par voie transdermique) en traitement de fond de leur douleur chronique. Par conséquent, il n'est pas possible d'isoler avec certitude les effets de PecFent seul.
Liste
tabulée des effets indésirables
Les effets
indésirables suivants ont été rapportés avec PecFent et/ou
d'autres médicaments contenant du fentanyl au
cours des essais cliniques ou
en post-marketing [fréquences définies comme : très fréquent
(≥ 1/10),
fréquent (≥ 1/100, < 1/10), peu fréquent
(≥ 1/1 000, < 1/100), rare (≥ 1/10 000,
< 1/1 000), très rare (< 1/10 000),
fréquence indéterminée (ne peut être estimée à partir des données
disponibles)].
| Fréquent | Peu fréquent | Fréquence indéterminée | |
| Infections et infestations |
Pneumonie
Rhinopharyngite Pharyngite Rhinite |
||
| Affections hématologiques et du système lymphatique | Neutropénie | ||
| Affections du système immunitaire | Hypersensibilité | ||
| Troubles du métabolisme et de la nutrition |
Déshydratation
Hyperglycémie Perte de l'appétit Augmentation de l'appétit |
||
| Affections psychiatriques | Désorientation |
Délire
Hallucination Syndrome confusionnel Dépression Trouble déficitaire de l'attention/hyperactivité Anxiété Humeur euphorique Nervosité |
Insomnie
Pharmacodépendance (addiction) Utilisation abusive |
| Affections du système nerveux |
Dysgueusie
Étourdissements Somnolence Céphalées |
Perte
de conscience Diminution du niveau de conscience Convulsions Agueusie Anosmie Troubles de la mémoire Parosmie Troubles de la parole Sédation Léthargie Tremblements |
|
| Affections de l'oreille et du labyrinthe |
|
Vertiges |
|
| Affections cardiaques |
|
Cyanose |
|
| Affections vasculaires |
|
Insuffisance
cardiovasculaire Lymphœdème Hypotension Bouffées vasomotrices |
Rougeur de la face |
| Affections respiratoires, thoraciques et médiastinales |
Épistaxis
Rhinorrhée Inconfort nasal (par exemple sensation de « brûlure nasale ») |
Obstruction
des voies aériennes supérieures
Douleur laryngopharyngée Rhinalgie Affection de la muqueuse nasale Toux Dyspnée Éternuement Congestion des voies respiratoires supérieures Congestion nasale Hypoesthésie intranasale Irritation de la gorge Écoulement pharyngé postérieur Sécheresse nasale |
Dépression respiratoire |
| Affections gastro-intestinales |
Vomissements
Nausées Constipation |
Perforation
intestinale
Péritonite Hypoesthésie buccale Paresthésie buccale Diarrhée Haut-le-cœur Douleur abdominale Affection de la langue Ulcération buccale Dyspepsie Sécheresse buccale |
|
| Affections de la peau et du tissu sous-cutané | Prurit |
Hyperhidrose
Urticaire |
|
| Affections musculosquelettiques et systémiques |
|
Arthralgie
Fasciculations musculaires |
|
| Affections du rein et des voies urinaires |
|
Anurie
Dysurie Protéinurie Hésitation mictionnelle |
|
| Affections des organes de reproduction et du sein |
|
Hémorragies vaginales |
|
| Troubles généraux et anomalies au site d'administration |
|
Douleur
thoracique d'origine extra-cardiaque
Asthénie Frissons Œdème de la face Œdème périphérique Trouble de la marche Pyrexie Fatigue Malaise Soif |
Syndrome
de sevrage*
Syndrome de sevrage néonatal, tolérance au médicament |
| Investigations |
|
Thrombopénie
Gain pondéral |
|
| Lésions, intoxications et complications liées aux procédures |
|
Chute
Mésusage délibéré du médicament Erreur médicamenteuse |
|
* Des
symptômes de sevrage des opioïdes tels que nausées, vomissements, diarrhée,
anxiété, frissons, tremblement et hypersudation ont été observés avec le
fentanyl administré par voie transmuqueuse.
Description de certains effets indésirables
Tolérance
La tolérance peut se développer lors d'une utilisation répétée.
Pharmacodépendance
L'utilisation répétée de PecFent peut entraîner une dépendance aux médicaments (pharmacodépendance), même à des doses thérapeutiques. Le risque de pharmacodépendance aux médicaments peut varier selon les facteurs de risque propres au patient, de la posologie et de la durée du traitement par opioïdes (voir rubrique Mises en garde spéciales et précautions d'emploi).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance Site internet : https://signalement.social-sante.gouv.fr.
Ce médicament n'est pas destiné à traiter les douleurs aiguës autres que les accès douloureux paroxystiques.
AVANT INSTAURATION DU TRAITEMENT :
- Convenir avec le patient d'une
stratégie thérapeutique comprenant la durée et les objectifs du
traitement.
- Informer le patient des risques et signes de troubles liés à l'usage des
opioïdes (TUO).
INFORMER
le patient et ses aidants que ce médicament contient une substance active en
quantité susceptible d'être fatale pour un enfant.
SURVEILLANCE pendant le traitement :
- Avoir des contacts fréquents avec le patient afin d'évaluer la
nécessité de poursuivre le traitement, d'envisager l'arrêt du
traitement et d'ajuster les doses si nécessaire.
- Détecter tout signe de recherche compulsive du produit
(par exemple demande de renouvellement trop précoce de la
prescription). Dans ce cadre, PASSER EN REVUE les médicaments
psychoactifs (tels que les benzodiazépines) et opioïdes utilisés en
concomitance.
NOUVEAU-NE DE MERE TRAITEE :
Après un traitement prolongé, le fentanyl peut provoquer un syndrome de
sevrage chez le nouveau-né. Il est recommandé de ne pas utiliser le
fentanyl pendant le travail et l'accouchement (y compris en cas de
césarienne) car le fentanyl franchit la barrière placentaire et peut
provoquer une dépression respiratoire chez le foetus. En cas
d'administration de ce médicament, un antidote pour l'enfant doit être
disponible immédiatement.
A CONSERVER dans un endroit sûr et sécurisé, inaccessible à d'autres
personnes en raison des risques,
associés à l'exposition accidentelle, au mésusage et à l'abus, pouvant avoir une
issue fatale.
CONTACTER LE MEDECIN en cas de :
- Saignements de nez récurrents.
- Baisse d'efficacité pour traiter les accès douloureux paroxystiques.
- Douleur ou sensibilité accrue à la douleur (hyperalgésie) qui ne répond pas à la dose plus élevée de médicament prescrite par le médecin.
- Sentiment de devenir dépendant à ce médicament.
- Association des symptômes suivants : nausées, vomissements, anorexie, fatigue, faiblesse, sensations vertigineuses, pression artérielle basse.
-
Arrêt de la respiration pendant le sommeil, de réveils nocturnes dus à un
essoufflement, de difficulté à rester endormi(e) ou une somnolence
excessive pendant la journée.
APPELER UNE AMBULANCE en cas de :
- Vertiges, malaise, somnolence importante.
- Respiration lente ou superficielle.
- Peau pâle et froide.
- Pouls faible.
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines (somnolence, étourdissement, vision floue).
EVITER la prise de boissons alcoolisées ou de médicaments contenant de l'alcool.
EVITER la prise de jus de pamplemousse.
SUSPENDRE l'allaitement pendant minimum 5 jours après la prise du médicament.
SPORTIFS : substance dopante.
Grossesse
Il n'existe pas de données suffisamment pertinentes concernant
l'utilisation de fentanyl chez la femme enceinte. Les études effectuées
chez l'animal ont mis en évidence une toxicité sur la reproduction
(voir rubrique Données de sécurité préclinique). Le risque
potentiel en clinique n'est pas connu. PecFent ne doit pas être utilisé
pendant la grossesse à moins d'une nécessité absolue.
Après un traitement prolongé, le fentanyl peut provoquer un syndrome de sevrage chez le nouveau-né. Il est recommandé de ne pas utiliser le fentanyl pendant le travail et l'accouchement (y compris en cas de césarienne) car le fentanyl franchit la barrière placentaire et peut provoquer une dépression respiratoire chez le fœtus. En cas d'administration de PecFent, un antidote pour l'enfant doit être disponible immédiatement.
Allaitement
Le fentanyl est excrété dans le lait maternel et peut entraîner une
sédation et une dépression respiratoire chez le nourrisson allaité. Le
fentanyl ne doit pas être utilisé par la femme allaitante et un délai
minimum de 5 jours doit impérativement être respecté entre la dernière
administration de fentanyl et la reprise de l'allaitement.
Fertilité
Il n'existe aucune donnée clinique concernant les effets du fentanyl sur la fertilité.
L'utilisation concomitante de fentanyl avec des médicaments contenant de l'oxybate de sodium est contre-indiquée (voir rubrique Contre-indications). Le traitement par l'oxybate de sodium doit être arrêté avant de débuter le traitement avec PecFent.
Chez l'homme, le fentanyl est métabolisé principalement par le système isoenzymatique 3A4 du cytochrome P450 (CYP3A4) ; des interactions potentielles peuvent donc survenir en cas d'administration concomitante de PecFent avec des médicaments ayant un effet sur l'activité du CYP3A4. L'administration concomitante de médicaments ayant un effet inducteur sur l'activité du CYP3A4 peut réduire l'efficacité de PecFent. L'administration concomitante de PecFent et d'inhibiteurs puissants du CYP3A4 (par exemple ritonavir, kétoconazole, itraconazole, troléandomycine, clarithromycine et nelfinavir) ou d'inhibiteurs modérés du CYP3A4 (amprénavir, aprépitant, diltiazem, érythromycine, fluconazole, fosamprénavir, jus de pamplemousse et vérapamil, par exemple) est susceptible d'entraîner une augmentation des concentrations plasmatiques du fentanyl, ce qui pourrait induire des effets indésirables graves, y compris une dépression respiratoire potentiellement fatale. Les patients recevant PecFent en même temps que des inhibiteurs modérés ou puissants du CYP3A4 doivent faire l'objet d'une surveillance étroite pendant une période prolongée. L'augmentation posologique doit être réalisée avec prudence.
L'administration concomitante d'autres dépresseurs du système nerveux central (autres opioïdes, sédatifs ou hypnotiques, anesthésiques généraux, phénothiazines, tranquillisants, myorelaxants, gabapentinoïdes (gabapentine et prégabaline), antihistaminiques sédatifs et alcool peut potentialiser les effets dépresseurs de chaque agent. L'utilisation concomitante d'opioïdes et de médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés augmente le risque de sédation, de dépression respiratoire, de coma et de décès en raison des effets additifs de dépression du SNC. La dose minimale efficace du médicament sédatif doit être utilisée et la durée d'utilisation concomitante doit être limitée (voir rubrique Mises en garde spéciales et précautions d'emploi).
Médicaments sérotoninergiques
L'administration concomitante de fentanyl et d'un médicament
sérotoninergique, tel qu'un inhibiteur sélectif de la recapture de la
sérotonine (ISRS), un inhibiteur de la recapture de la sérotonine et de
la noradrénaline (IRSN) ou un inhibiteur de la monoamine oxydase
(IMAO), peut augmenter le risque de syndrome sérotoninergique, une
pathologie pouvant mettre en jeu le pronostic vital.
L'utilisation de PecFent n'est pas recommandée chez les patients ayant reçu des inhibiteurs de la monoamine oxydase (IMAO) dans les 14 jours précédant la prise de PecFent, une potentialisation sévère et imprévisible ayant été décrite lors de l'administration concomitante d'IMAO et d'antalgiques opioïdes.
L'utilisation concomitante d'antalgiques agonistes/antagonistes opioïdes partiels (buprénorphine, nalbuphine, pentazocine, par exemple) n'est pas recommandée. Ils possèdent une forte affinité pour les récepteurs opioïdes avec une activité intrinsèque relativement faible et, par conséquent, ils antagonisent partiellement l'effet analgésique du fentanyl pouvant ainsi induire un syndrome de sevrage chez les patients dépendants aux opioïdes.
L'utilisation concomitante d'oxymétazoline administrée par voie nasale s'est avérée réduire l'absorption de PecFent (voir rubrique Propriétés pharmacocinétiques). L'utilisation concomitante de décongestionnants vasoconstricteurs nasaux pendant la phase de titration n'est donc pas recommandée car elle peut conduire le patient à déterminer une dose plus forte que nécessaire. Le traitement d'entretien par PecFent peut également être moins efficace chez les patients présentant une rhinite lorsqu'il est administré en même temps qu'un décongestionnant vasoconstricteur. Dans ce cas, il est recommandé de conseiller aux patients d'interrompre le traitement avec le décongestionnant nasal.
L'utilisation concomitante de PecFent et d'autres médicaments (autres que l'oxymétazoline) administrés par voie nasale n'a pas été évaluée dans le cadre d'essais cliniques. Il convient d'éviter les autres traitements administrés par voie nasale dans les 15 minutes suivant l'administration de PecFent.
Le traitement doit être instauré et suivi par un médecin ayant l'expérience de la prise en charge des traitements opioïdes chez les patients atteints d'un cancer. Les médecins doivent prendre en considération le risque potentiel d'utilisation abusive du fentanyl.
Posologie
La posologie de PecFent doit être augmentée jusqu'à obtention d'une dose «
efficace » (phase de titration) assurant une analgésie suffisante avec un
minimum d'effets indésirables (ou intolérables) sur deux traitements consécutifs
d'épisodes d'accès douloureux paroxystiques. L'efficacité d'une dose donnée
doit être évaluée sur la période de 30 minutes suivant son administration.
Les patients doivent être surveillés étroitement jusqu'à l'obtention de la dose efficace.
PecFent est disponible en deux dosages : 100 microgrammes/pulvérisation et 400 microgrammes/pulvérisation.
Une dose de PecFent peut comprendre l'administration de 1 pulvérisation (doses de 100 microgrammes ou 400 microgrammes) ou de 2 pulvérisations (doses de 200 microgrammes ou de 800 microgrammes) du même dosage (soit le dosage à 100 microgrammes, soit celui à 400 microgrammes).
Les patients ne doivent pas utiliser plus de 4 doses par jour. Les patients doivent attendre au moins 4 heures après une dose avant de traiter un autre accès douloureux paroxystique par PecFent.
PecFent peut délivrer des doses de 100, 200, 400 ou 800 microgrammes comme suit :
|
Dose requise
(microgrammes) |
Dosage du produit
(microgrammes) |
Quantité |
| 100 | 100 | Une pulvérisation dans une seule narine |
| 200 | 100 | Une pulvérisation dans chaque narine |
| 400 | 400 | Une pulvérisation dans une seule narine |
| 800 | 400 | Une pulvérisation dans chaque narine |
Dose initiale
- La dose initiale de PecFent pour traiter les épisodes d'accès douloureux paroxystiques est toujours de 100 microgrammes (une pulvérisation), y compris chez les patients traités jusqu'alors avec d'autres produits à base de fentanyl dans cette même indication.
- Les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique par PecFent.
Méthode de
titration
- Pour les besoins de la titration initiale, il devra être prescrit au patient un flacon (2 pulvérisations ou 8 pulvérisations) de PecFent 100 microgrammes/pulvérisation.
- Dans les cas où la dose initiale prescrite de 100 microgrammes procure une analgésie insuffisante, il pourra être demandé au patient de procéder à deux pulvérisations de 100 microgrammes (une dans chaque narine) lors du prochain accès douloureux paroxystique. Si cette dose reste sans effet, on pourra prescrire au patient un flacon de PecFent 400 microgrammes/pulvérisation en recommandant une pulvérisation de 400 microgrammes lors de l'épisode douloureux suivant. Si l'analgésie demeure insuffisante, la dose pourra être augmentée à deux pulvérisations de 400 microgrammes (une dans chaque narine).
- Dès l'instauration du traitement, les patients doivent être suivis étroitement et la dose augmentée jusqu'à l'obtention de la dose efficace, confirmée sur deux épisodes consécutifs d'accès douloureux paroxystiques traités.
Titration
chez les patients changeant de produit à base de fentanyl à libération
immédiate
Les profils
pharmacocinétiques des médicaments à base de fentanyl à libération immédiate
peuvent présenter des différences notables, pouvant être à l'origine de
différences d'absorption du fentanyl (vitesse et quantité) importantes sur le
plan clinique.
Par conséquent, lors du relais entre deux médicaments contenant du fentanyl et indiqués dans le traitement de la douleur paroxystique, y compris les formulations nasales, il est crucial de recommencer la titration avec le nouveau médicament et de ne pas remplacer le médicament en gardant la même dose (même nombre de microgrammes).
Traitement
d'entretien
Une fois la
dose efficace établie pendant la phase de titration, les patients doivent
continuer à prendre cette dose sans dépasser la posologie maximale de 4 doses
par jour.
Réajustement
de la dose
En règle
générale, la dose d'entretien de PecFent ne doit être
augmentée que si la dose utilisée n'apporte pas un soulagement de la douleur
satisfaisant lors de plusieurs accès consécutifs.
Il peut être nécessaire d'ajuster la posologie du traitement opioïde de fond si les patients présentent régulièrement plus de quatre accès douloureux paroxystiques par 24 heures.
En l'absence de contrôle adéquat de la douleur, la possibilité d'hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique Mises en garde spéciales et précautions d'emploi).
En cas d'effets indésirables intolérables ou persistants, la dose doit être réduite ou le traitement par PecFent remplacé par un autre analgésique.
Durée et objectifs du traitement
Avant l’instauration du traitement par PecFent, une stratégie thérapeutique comprenant la durée et les
objectifs du traitement, doivent être convenus avec le patient, conformément aux lignes directrices
relatives à la prise en charge de la douleur. Pendant le traitement, des contacts fréquents doivent avoir
lieu entre le médecin et le patient afin d’évaluer la nécessité de poursuivre le traitement, d’envisager
l’arrêt du traitement et d’ajuster les doses si nécessaire. En l’absence d’un contrôle adéquat de la
douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit
être envisagée (voir rubrique Mises en garde spéciales et précautions d'emploi).
PecFent ne doit pas être utilisé plus longtemps que nécessaire.
Arrêt du
traitement
PecFent doit être arrêté
immédiatement si le patient ne présente plus d'accès douloureux paroxystiques.
Le traitement de la douleur chronique de fond doit être maintenu tel que
prescrit.
Si l'arrêt de
tous les traitements opioïdes s'avère nécessaire, le patient doit être
surveillé étroitement par le médecin, une diminution progressive du traitement
opioïde étant nécessaire pour éviter le risque d'apparition de symptômes liés à
un sevrage brutal.
Populations
particulières
Sujets âgés (de plus de 65 ans)
Dans le programme
d'essais cliniques de PecFent, 104 (26,1 %) patients
étaient âgés de plus de 60 ans, 67
(16,8 %) de plus de 65 ans et 15 (3,8 %) de plus de 75 ans. Rien n'indiquait
que chez les patients âgés la dose efficace tendait à être plus faible ou que
les effets indésirables aient été plus nombreux. Néanmoins, étant donné
l'importance des fonctions rénale et hépatique dans le métabolisme et la
clairance du fentanyl, des précautions supplémentaires s'imposent lors de
l'utilisation de PecFent chez les sujets âgés. Aucune
donnée sur la pharmacocinétique de PecFent chez les
patients âgés n'est disponible.
Insuffisance
hépatique ou rénale
PecFent doit être administré
avec prudence chez les patients présentant une insuffisance rénale ou hépatique
modérée ou grave (voir rubrique Mises en garde spéciales et précautions d'emploi).
Population pédiatrique
La sécurité et l'efficacité de PecFent chez les enfants et adolescents âgés de moins de 18 ans n'ont pas encore été établies.
Aucune donnée n'est disponible.
Mode
d'administration
Voie nasale uniquement.
Le flacon ne doit être sorti de l'emballage extérieur avec sécurité enfant qu'au moment de l'utilisation et le capuchon de protection doit être retiré. Avant la première utilisation, le flacon pulvérisateur doit être amorcé en le tenant en position verticale et en pressant et relâchant plusieurs fois les ailettes repose-doigt situées de chaque côté de l'embout nasal jusqu'à l'apparition d'une barre verte dans la fenêtre du compteur de doses (normalement visible après quatre pulvérisations).
Flacon de 2
pulvérisations :
Le flacon de 2
pulvérisations ne peut pas être réamorcé et lorsque les deux doses ont été
utilisées ou s'il s'est écoulé plus de 5 jours depuis l'amorçage, le flacon et
le contenu doivent être éliminés comme il est expliqué à la rubrique Instructions
pour l'utilisation, la manipulation et l'élimination.
Flacon de 8
pulvérisations :
Si le produit
n'a pas été utilisé pendant 5 jours, le flacon doit être réamorcé en effectuant
une pulvérisation. Il doit être recommandé au patient d'inscrire la date de
première utilisation à l'emplacement prévu à cet effet sur l'étiquette de
l'emballage extérieur avec sécurité enfant.
Pour administrer PecFent, introduire l'embout nasal dans la narine, à environ 1 cm de distance de l'entrée de la narine et en l'orientant vers la racine du nez. Une pulvérisation est ensuite administrée en pressant puis relâchant les ailettes repose-doigt de part et d'autre de l'embout nasal. Un « clic » se fera alors entendre et le nombre affiché par le compteur de doses augmentera d'une unité.
Les patients doivent être avertis qu'ils peuvent ne pas sentir l'administration de la pulvérisation et qu'ils doivent donc se fier au clic sonore et à la modification de l'affichage du compteur pour avoir confirmation de la délivrance effective d'une pulvérisation.
La brume de gouttelettes produite par le pulvérisateur de PecFent forme un gel à la surface de la muqueuse nasale. Il est recommandé aux patients de ne pas se moucher immédiatement après l'administration de PecFent.
Le capuchon de protection doit être remis en place après chaque utilisation et le flacon replacé dans l'emballage extérieur avec sécurité enfant pour une conservation adéquate et sans risque.
Durée de conservation :
Flacon de 8 pulvérisations :
3 ans.
Après ouverture : 60 jours.
Précautions particulières de conservation :
À conserver à une température ne dépassant pas 25 °C.
Ne pas congeler.
Conserver
le flacon dans l'emballage extérieur avec sécurité enfant à l'abri de
la lumière.
Toujours conserver le flacon, même vide, dans l'emballage
extérieur avec sécurité enfant.
Sans objet.
Les symptômes attendus d'un surdosage de fentanyl par voie nasale devraient être de même nature que ceux du fentanyl par voie intraveineuse et des autres opioïdes. Ils résultent de son action pharmacologique, l'effet majeur le plus grave étant la dépression respiratoire. Un coma peut aussi survenir.
La conduite à tenir devant un surdosage par opioïdes consiste à prendre immédiatement les mesures suivantes : maintien de la perméabilité des voies aériennes, stimulation physique et verbale du patient, évaluation du niveau de conscience ainsi que du statut ventilatoire et circulatoire et, si nécessaire, mise en œuvre d'une ventilation assistée (assistance respiratoire). Une leucoencéphalopathie toxique a également été observée lors d'un surdosage en fentanyl.
Pour le traitement du surdosage (ingestion accidentelle) chez un sujet n'ayant jamais reçu d'opioïdes, une voie d'abord veineuse doit être mise en place et de la naloxone ou d'autres antagonistes spécifiques des opioïdes doivent être administrés selon la situation clinique. La durée de la dépression respiratoire due au surdosage peut être plus longue que les effets de l'antagoniste opioïde (p. ex. la demi-vie de la naloxone varie entre 30 et 81 minutes) et une administration répétée peut s'avérer nécessaire. Pour une information complète sur l'emploi de l'antagoniste opioïde considéré dans ce cadre, se reporter au résumé des caractéristiques du produit.
Pour le traitement du surdosage chez des patients recevant un traitement opioïde de fond, une voie d'abord veineuse doit être mise en place. L'utilisation judicieuse de naloxone ou d'un autre antagoniste morphinique peut être justifiée dans certaines situations, mais on tiendra compte du risque de survenue d'un syndrome de sevrage aigu.
Il convient de noter que bien qu'une augmentation statistiquement significative de la Cmax ait été observée après administration d'une seconde dose de PecFent une ou deux heures après la dose initiale, l'ampleur de cette augmentation n'apparaît pas suffisante pour qu'une accumulation ou une surexposition cliniquement préoccupante puisse survenir, ce qui constitue une marge de sécurité assez importante pour l'intervalle de quatre heures recommandé entre les doses.
Bien qu'aucun cas de rigidité musculaire interférant avec la respiration n'ait été observé après administration de PecFent, c'est là un effet indésirable possible associé à l'utilisation de fentanyl et d'autres opioïdes. La prise en charge d'une éventuelle rigidité musculaire comprend la mise en place de la ventilation assistée, l'administration d'un antagoniste opioïde et, en dernier recours, la curarisation.
Des cas de respiration de Cheyne-Stokes ont été observés lors d'un surdosage de fentanyl, en particulier chez les patients ayant des antécédents d'insuffisance cardiaque.
Classe pharmacothérapeutique : Analgésiques, opioïdes, dérivés de la phénylpipéridine, Code ATC : N02AB03.
Mécanisme d'action
Le
fentanyl est un analgésique opioïde, interagissant essentiellement avec
le récepteur morphinique µ. Ses principaux effets thérapeutiques sont
l'analgésie et la sédation. Les effets pharmacologiques secondaires
sont : dépression respiratoire, bradycardie, hypothermie, constipation,
myosis, dépendance physique et euphorie.
Les opioïdes peuvent agir sur les axes hypothalamo-hypophyso-surrénalien ou gonadotrope. Certaines modifications qui peuvent être observées sont notamment une augmentation de la prolactinémie et des diminutions des taux plasmatiques de cortisol et de testostérone. Des signes et symptômes cliniques dus à ces modifications hormonales peuvent être manifestes.
Effets pharmacodynamiques
Une étude croisée, randomisée en double aveugle versus placebo,
a été menée. Au cours de cette étude, 114 patients présentant en
moyenne 1 à 4 épisodes quotidiens d'accès douloureux paroxystiques
(ADP) sous traitement de fond opioïde ont été inclus dans une phase
initiale de titration en ouvert afin de déterminer la dose efficace de
PecFent (étude CP043). Les patients entrant dans la phase en double
aveugle ont traité de façon aléatoire jusqu'à 10 épisodes d'ADP avec
PecFent (7 épisodes) ou un placebo (3 épisodes).
Parmi les patients entrant dans la phase de titration, pour seulement 7 (6,1 %) d'entre eux la dose efficace n'a pu être déterminée pour cause d'absence d'efficacité et 6 (5,3 %) autres sont sortis de l'étude pour cause d'événements indésirables.
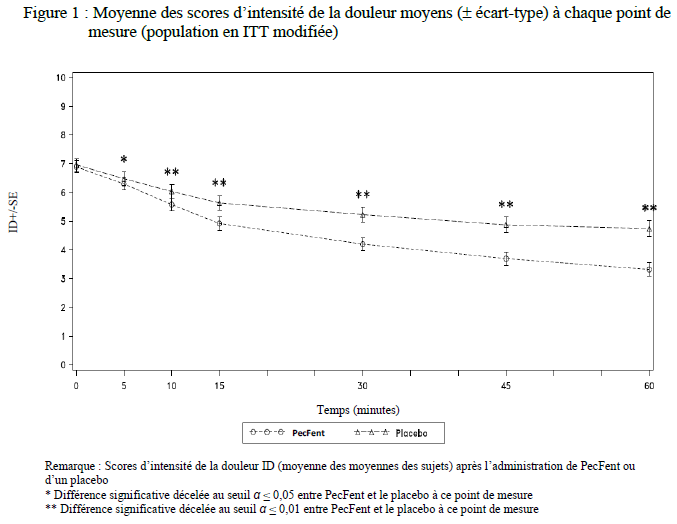
Le critère de jugement principal consistait en une comparaison des sommes des différences d'intensité de la douleur 30 minutes après l'administration (SPID30), lesquelles s'élevaient respectivement à 6,57 pour les épisodes traités par PecFent et 4,45 pour le placebo (p < 0,0001). Le score SPID des épisodes traités par PecFent était également apparu significativement différent de celui du placebo 10, 15, 45 et 60 minutes après l'administration.
Les scores moyens d'intensité de la douleur (73 patients) pour tous les accès douloureux paroxystiques traités par PecFent (459 épisodes) étaient significativement inférieurs à ceux des patients sous placebo (200 épisodes) 5, 10, 15, 30, 45 et 60 minutes après l'administration (voir Figure 1).
La
supériorité de l'efficacité de PecFent sur celle du placebo a été
confirmée par les données issues des critères de jugement secondaires,
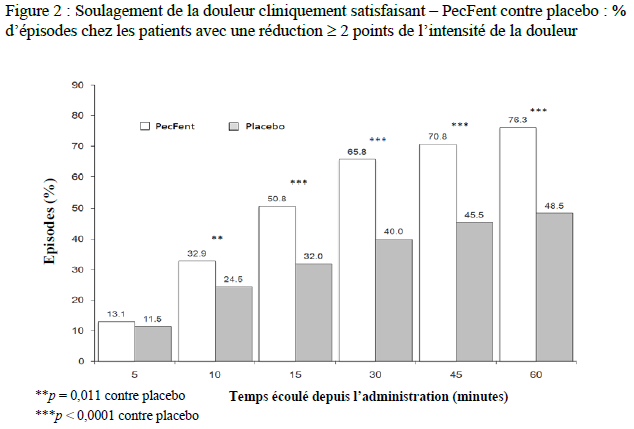
dont le nombre d'épisodes d'ADP avec un soulagement de la douleur
cliniquement satisfaisant, défini par une réduction d'au moins 2 du
score d'intensité de la douleur (Figure 2).
Une étude comparative randomisée en double aveugle versus substance active (étude 044), dont le plan expérimental était similaire à celui de l'étude 043, a été menée chez des patients accoutumés aux opioïdes, présentant des accès douloureux paroxystiques d'origine cancéreuse et utilisant régulièrement des doses stables d'opioïdes. Dans cette étude, PecFent s'est montré supérieur au sulfate de morphine à libération immédiate, supériorité qu'a démontrée le critère de jugement principal, à savoir la différence d'intensité de la douleur à 15 minutes avec un score de 3,02 sous PecFent versus 2,69 sous sulfate de morphine à libération immédiate (p = 0,0396).
Dans une étude de la sécurité au long cours en ouvert (étude 045), 355 patients sont entrés dans la phase thérapeutique de 16 semaines durant laquelle 42 227 épisodes d'accès douloureux paroxystiques d'origine cancéreuse ont été traités par PecFent. Cent de ces patients ont continué le traitement sur une durée pouvant atteindre 26 mois dans le cadre d'une extension d'étude. Parmi les 355 patients traités dans la phase thérapeutique en ouvert, 90 % n'ont pas eu besoin d'augmenter la dose.
Lors de l'étude randomisée, comparative contre placebo (CP043), 9,4 % des 459 épisodes d'ADP traités par PecFent chez 73 patients ont nécessité le recours à d'autres médicaments (de secours) dans les 60 minutes suivant l'administration. Lors de l'étude en ouvert à plus long terme (CP045), ce chiffre s'élevait à 6,0 % des 42 227 épisodes chez 355 patients traités par PecFent pendant au plus 159 jours de traitement.
Introduction
générale
Le fentanyl
est une substance fortement lipophile qui peut être absorbée très rapidement à
travers la muqueuse nasale et plus lentement par voie gastro-intestinale. Le fentanyl
subit un effet de premier passage hépatique et un métabolisme intestinal, ses
métabolites ne participant pas aux effets thérapeutiques du fentanyl.
PecFent utilise la technologie PecSys de pulvérisation nasale pour moduler la délivrance et l'absorption du fentanyl. La technologie PecSys permet au produit d'être vaporisé dans la zone antérieure de la cavité nasale en une fine brume de gouttelettes qui forment un gel au contact des ions calcium présents dans la muqueuse nasale.
Le fentanyl diffuse à partir du gel et est absorbé à travers la muqueuse nasale ; cette absorption de fentanyl modulée par le gel limite la concentration plasmatique maximale (Cmax) tout en permettant d'atteindre ce pic (Tmax) rapidement.
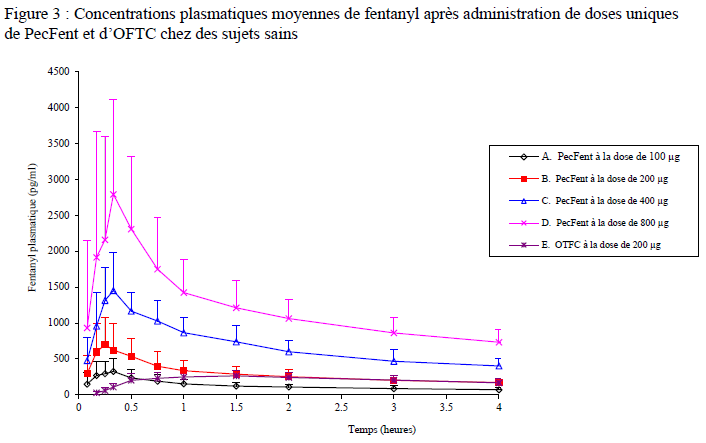
Absorption
Dans une étude
pharmacocinétique comparant PecFent (100, 200, 400 et
800 microgrammes) au citrate de fentanyl oral transmuqueux
(OTFC, 200 microgrammes), le fentanyl a été rapidement absorbé après
administration intranasale d'une dose unique de PecFent,
avec un Tmax médian de 15 à 21 minutes (le
Tmax de l'OTFC était d'environ 90
minutes). La pharmacocinétique du fentanyl a fait preuve d'une extrême
variabilité après traitement tant avec PecFent
qu'avec l'OFTC. La biodisponibilité relative du fentanyl libéré par PecFent comparée à celle de l'OFTC 200 microgrammes était
d'environ 120 %.
Les principaux paramètres pharmacocinétiques sont indiqués dans le tableau suivant. Paramètres pharmacocinétiques chez les sujets adultes recevant PecFent et l'OFTC
|
Paramètres
pharmaco- cinétiques (moyenne [CV]) |
PecFent | OTFC | |||
|
100 micro- grammes |
200 micro- grammes |
400 micro- grammes |
800 micro- grammes |
200 micro- grammes |
|
| Tmax (heures)* | 0,33 (0,08-1,50) | 0,25 (0,17-1,60) | 0,35 (0,25-0,75) | 0,34 (0,17-3,00) | 1,50 (0,50-8,00) |
| Cmax (pg/ml) | 351,5 (51,3) | 780,8 (48,4) | 1 552,1 (26,2) | 2 844,0 (56,0) | 317,4 (29,9) |
| ASC (pg.h/ml) | 2 460,5 (17,9 | 4 359,9 (29,8) | 7 513,4 (26,7) | 17 272 (48,9) | 3 735,0 (32,8) |
| t1/2 (heures) | 21,9 (13,6) | 24,9 (51,3) | 15,0 (24,7) | 24,9 (92,5) | 18,6 (31,4) |
* Données pour
le Tmax présentées sous forme de médiane
(plage) - CV = coefficient de variation
Les courbes pour chaque niveau de dose ont une forme similaire, l'augmentation des niveaux de dose produisant une augmentation des taux plasmatiques de fentanyl. La proportionnalité à la dose a été démontrée pour Cmax et l'aire sous la courbe (ASC) sur l'éventail de doses de 100 microgrammes à 800 microgrammes (voir Figure 3). En cas de substitution de PecFent à une autre forme de fentanyl dans le traitement des accès douloureux paroxystiques, il est nécessaire de réaliser indépendamment une titration de la dose avec PecFent, car la biodisponibilité diffère significativement d'un produit à l'autre.
Une étude pharmacocinétique a été menée afin d'évaluer l'absorption et la sécurité d'une dose unique de PecFent chez des patients présentant une rhinite allergique saisonnière d'origine pollinique, par comparaison de trois états : absence de provocation, rhinite aiguë provoquée et rhinite aiguë provoquée suivie d'un traitement par oxymétazoline.
La comparaison de l'absence de provocation et de la rhinite aiguë provoquée montre que la rhinite aiguë n'a aucun effet cliniquement significatif sur la Cmax, le Tmax ou l'exposition globale au fentanyl. Après traitement par oxymétazoline de la rhinite aiguë, une diminution de la Cmax et de l'exposition ainsi qu'un allongement du Tmax statistiquement et possiblement cliniquement significatifs ont été observés.
Distribution
Le fentanyl
est fortement lipophile et est bien distribué à partir du compartiment
vasculaire, avec un grand volume de distribution apparent. Les données obtenues
chez l'animal ont montré que l'absorption du fentanyl est suivie d'une
distribution rapide dans le cerveau, le cœur, les poumons, les reins et la
rate, puis d'une redistribution plus lente dans les muscles et la graisse.
La liaison du fentanyl aux protéines plasmatiques est de l'ordre de 80 à 85 %. La principale protéine de liaison est l'alpha-1 glycoprotéine acide (AGP), mais l'albumine et les lipoprotéines contribuent également dans une certaine mesure. La fraction libre du fentanyl augmente avec l'acidose.
Biotransformation
Les voies
métaboliques après l'administration nasale de PecFent
n'ont pas été caractérisées dans le cadre d'études cliniques. Le fentanyl est
métabolisé dans le foie en norfentanyl par l'isoforme CYP3A4 du cytochrome. Le norfentanyl
n'est pas pharmacologiquement actif dans les études
menées chez l'animal. Il est éliminé à plus de 90 % par biotransformation en
métabolites N-désalkylés et hydroxylés inactifs.
Élimination
L'élimination
du fentanyl après l'administration nasale de PecFent
n'a pas été caractérisée dans une étude d'équilibre de masse. Moins de
7 % de
la dose administrée de fentanyl sont excrétés sous forme inchangée dans
l'urine
et seulement environ 1 % est excrété sous forme inchangée dans les
fèces. Les métabolites sont essentiellement excrétés dans l'urine,
tandis que l'excrétion fécale est moins importante.
La clairance plasmatique totale du fentanyl après administration intraveineuse est d'environ 42 l/h.
Linéarité/non-linéarité
La
proportionnalité à la dose a été démontrée pour la Cmax
et l'ASC sur un éventail de doses de 100 microgrammes à 800 microgrammes.
L'effet de l'insuffisance rénale ou hépatique sur la pharmacocinétique de PecFent n'a pas été étudié.
Les analgésiques opioïdes peuvent altérer les capacités mentales et/ou physiques nécessaires à la conduite de véhicules et à l'utilisation de machines.
Il est recommandé aux patients de ne pas conduire ni utiliser de machines s'ils présentent une somnolence, des vertiges ou des troubles de la vision ou d'autres effets indésirables susceptibles d'altérer leur aptitude à conduire ou à utiliser des machines.
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité et cancérogenèse n'ont pas révélé de risque particulier pour l'homme.
Les études de toxicité sur le développement embryofœtal menées chez le rat et le lapin n'ont mis en évidence aucune malformation ou modification du développement induite par le produit lorsque celui-ci est administré durant l'organogenèse.
Dans une étude sur la fertilité et les premiers stades du développement embryonnaire chez le rat, un effet transmis par les mâles a été observé à forte dose (300 mcg/kg/jour, SC) concordant avec les effets sédatifs du fentanyl dans les études animales.
Dans les
études du développement pré- et post-natal chez le rat, le taux de survie
de la progéniture a été significativement diminué à des doses entraînant une
toxicité maternelle sévère. D'autres résultats observés chez la progéniture de
la génération F1 avec des doses maternelles toxiques consistaient en un retard
du développement physique, des fonctions sensorielles, des réflexes et du
comportement.
Ces effets
pourraient être aussi bien indirects et imputables à une carence en soins
maternels et /ou à une diminution du taux de lactation que la résultante d'un
effet direct du fentanyl sur la progéniture.
Les études de cancérogenèse (test alternatif par voie cutanée chez la souris transgéniques Tg.AC durant 26 semaines ; étude de cancérogenèse par voie sous-cutanée chez le rat durant deux ans) avec le fentanyl n'ont pas révélé de résultats suggérant un potentiel oncogène. L'analyse des coupes de cerveau provenant de l'étude de cancérogenèse réalisée chez le rat a montré des lésions cérébrales chez les animaux ayant reçu des doses élevées de citrate de fentanyl. La pertinence clinique de ces résultats n'est pas connue.
Les
flacons de PecFent partiellement utilisés peuvent
contenir une quantité de médicament suffisante pour nuire à un enfant
ou mettre
sa vie en danger. Même s'il reste peu ou pas de médicament dans le
flacon de PecFent, celui-ci doit être éliminé correctement, comme
suit :
o Les patients et les aidants doivent être avertis que tous les flacons de PecFent utilisés, partiellement utilisés et non utilisés doivent être éliminés correctement. Les patients doivent recevoir des instructions à cet égard.
o S'il reste dans le flacon des doses thérapeutiques non destinées à être utilisées, le patient doit les expulser comme suit :
Flacon de 8 pulvérisations :
o En dirigeant le pulvérisateur loin de lui (et loin d'autres personnes) et en expulsant la solution pour pulvérisation restante jusqu'à ce que le chiffre « 8 » s'affiche sur le compteur de doses et qu'il ne reste plus de pulvérisations thérapeutiques à pleine dose délivrables par le flacon.
o Une fois le compteur passé à « 8 », le patient doit continuer à presser quatre fois au total sur les ailettes repose-doigts (une légère résistance sera ressentie) afin d'expulser tout le médicament résiduel du flacon.
o Lorsque les 8 pulvérisations thérapeutiques auront été émises, le patient n'entendra pas de clic et le compteur n'avancera pas au-delà de « 8 » ; les autres pulvérisations ne seront pas des pulvérisations à pleine dose et ne devront pas être utilisées dans un but thérapeutique.
o Les patients et les aidants doivent être avertis que tous les flacons de PecFent utilisés, partiellement utilisés et non utilisés doivent être éliminés correctement. Les patients doivent recevoir des instructions à cet égard.
o S'il reste dans le flacon des doses thérapeutiques non destinées à être utilisées, le patient doit les expulser comme suit :
Flacon de 8 pulvérisations :
o En dirigeant le pulvérisateur loin de lui (et loin d'autres personnes) et en expulsant la solution pour pulvérisation restante jusqu'à ce que le chiffre « 8 » s'affiche sur le compteur de doses et qu'il ne reste plus de pulvérisations thérapeutiques à pleine dose délivrables par le flacon.
o Une fois le compteur passé à « 8 », le patient doit continuer à presser quatre fois au total sur les ailettes repose-doigts (une légère résistance sera ressentie) afin d'expulser tout le médicament résiduel du flacon.
o Lorsque les 8 pulvérisations thérapeutiques auront été émises, le patient n'entendra pas de clic et le compteur n'avancera pas au-delà de « 8 » ; les autres pulvérisations ne seront pas des pulvérisations à pleine dose et ne devront pas être utilisées dans un but thérapeutique.
Aussitôt que l'utilisation de PecFent n'est plus nécessaire, tous les flacons utilisés ou non utilisés doivent être systématiquement remis dans leur emballage extérieur avec sécurité enfant et jetés, conformément à la réglementation en vigueur, ou rapportés à la pharmacie.
Stupéfiant :
· Prescription limitée à 28 jours.
· Délivrance limitée à 7 jours maximum.
Prescription sur ordonnance répondant aux spécifications fixées par l'arrêté du 31 Mars 1999.
Solution pour pulvérisation nasale (flacon pulvérisateur).
Solution aqueuse limpide ou quasiment limpide, incolore.
Flacon (verre transparent de type I) muni d'une pompe doseuse avec compteur de doses sonore et capuchon de protection (capuchon transparent pour le flacon de 8 pulvérisations). Dans chaque cas, le produit est conditionné dans un emballage extérieur avec sécurité enfant formant une coque.
Le flacon contient :
1,55 ml, permettant l'administration de 8 pulvérisations à pleine dose.
Les flacons dans leur emballage extérieur avec sécurité enfant sont fournis en boîte contenant :
Pour le flacon de 8 pulvérisations : 1 flacon.
PecFent 100 microgrammes/pulvérisation, solution pour pulvérisation nasale
Chaque ml de solution contient 1 000 microgrammes de fentanyl (sous forme de citrate).
1 pulvérisation (100 microlitres) contient 100 microgrammes de fentanyl (sous forme de citrate).
Le flacon contient :
1,55 ml (1 550 microgrammes de fentanyl) - flacon de 8 pulvérisations
Excipient(s) à effet notoire :
Chaque pulvérisation contient 0,02 mg de parahydroxybenzoate de propyle (E216).
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Pectine (E440)
Mannitol (E421)
Alcool phényléthylique
Parahydroxybenzoate de propyle (E216)
Saccharose
Acide chlorhydrique (0,36 %) ou hydroxyde de sodium (pour ajustement du pH)
Eau purifiée